10月15日,清华大学医学院生物医学工程系刘晓冬课题组在《细胞-通讯》(Cell Reports)期刊在线发表了题为“PKD2-L1/PKD1-L3通道‘钙离子内流操控型钙电流’提升多模态时变刺激下的感觉响应”(Influx-Operated Ca2+ Entry via PKD2-L1/PKD1-L3 Channels Facilitates Sensory Responses to Polymodal Transient Stimuli)的研究长文。论文首次报告了传感受体-离子通道复合体响应时变型刺激的正-负自反馈协同工作模式,揭示了生命体调控细胞传感及生理感觉的新机制,是离子通道钙信号及感觉信号领域的重要进展。生物医学工程系硕士生胡明峰、直博生刘玉霞以及技术员吴晋芝为本文的共同第一作者,刘晓冬博士为本文的通讯作者。
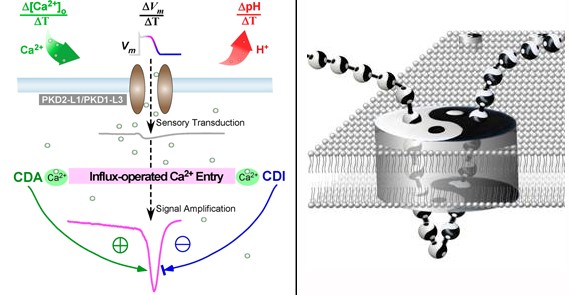
左图为分子传感器(传感受体-通道蛋白复合体)通过钙依赖自反馈产生“钙离子内流操控型钙电流”,可将多个模态刺激的响应放大为钙峰信号,实现通道对刺激信号变化率(激励信号的时间微分)的特异性感知。右图卡通形象说明了传感放大机制中的正-负反馈,体现了钙离子在大量重要生命过程中的作用方式:易化(阳)-抑制(阴)两方面在时空上实现协同调控。
瞬时受体电位(TRP)通道是生命体和细胞的重要“分子传感器”。在来源于内部环境和外部世界的刺激下,TRP通道能够跨膜导入钙离子等阳离子,可介导疼痛、温度、机械力(如流体剪切力)、化学(如辣椒素)、基本味觉等多种重要感知功能。多囊型TRPP是TRP家族中的重要成员,其中TRPP2(PKD2)与PKD1可发生突变并导致遗传性多囊肾(ADPKD),二者组成的通道复合体表达在肾纤毛上介导在机械刺激下的钙响应;目前认为PKD突变造成了流体感知功能及钙信号的紊乱,进而引发多囊肾病变。与之高度类似,TRPP3(PKD2-L1)通道复合体也可表达在细胞纤毛上并介导其钙动态;此外TRPP3也与多个模态的其它重要感觉功能(如酸味觉及反感性咸味觉等)密切相关。然而,TRPP通道复合体(如PKD2/PKD1复合体、PKD2-L1/PKD1-L3复合体)的传感能力一直以来存在诸多争议,主要是尚且缺乏清晰有力的证据支持:重组通道复合体对于生理性刺激的响应非常微弱,远远偏离预期中的刺激-响应关系曲线。
刘晓冬研究组针对TRPP3通道复合体发现:凭借自身钙离子内流介导的正负反馈,通道可产生“钙峰”型(Ca2+ spikes)响应,进而调节其刺激-响应关系曲线、有效提升对多种时变型刺激的感知能力。对刺激信号上升沿或下降沿(微分信号)的特殊敏感性是许多感觉系统的共有特性,此项研究揭示的钙依赖性反馈调节机制为通道提供了一个“时间窗口”,进而能够特异性地响应实验中钙浓度、膜电位及pH值的瞬时变化,是细胞纤毛的流体感知、听觉纤毛的机械振动感知等过程中的潜在机制。此研究也为至今尚未攻克的重要通道病—遗传性多囊肾提供了崭新的研究思路和方向。
刘晓冬博士先后毕业于浙江大学(本科)、清华大学(硕士)及美国凯斯西储大学(博士),并在美国约翰霍普金斯大学神经科学系和生物医学工程系完成了博士后研究。刘晓冬博士于2010年入职清华大学医学院生物医学工程系担任课题组长(P.I./Professor)以及清华大学生命学院兼职教授(Adjunct Professor),同时也是清华大学IDG/麦戈文脑研究院的研究员。刘晓冬实验室致力于“合成电生理学”研究,属工程科学与生命科学深度交叉的新兴领域。课题组目前通过在分子和细胞水平上功能重建重要离子通道及其跨膜信号,以研究与通道相关的病生理机制及干预手段。该项研究得到了国家自然科学基金委、北京市自然科学基金委、国家973以及清华大学生命科学联合中心(CLS)的支持。(摘自清华新闻网)
论文链接:http://www.cell.com/cell-reports/abstract/S2211-1247(15)01066-9

 010-62772847
010-62772847 kyyyb@tsinghua.edu.cn
kyyyb@tsinghua.edu.cn 版权所有 © 清华大学科研院
版权所有 © 清华大学科研院 总浏览人数:
总浏览人数:


 010-62772847
010-62772847 kyyyb@tsinghua.edu.cn
kyyyb@tsinghua.edu.cn 版权所有 © 清华大学科研院
版权所有 © 清华大学科研院 总浏览人数:
总浏览人数:
